Descubierto un gen crucial para el desarrollo del sarcoma de Ewing
Investigadores del Institut de Recerca Sant Joan de Déu, en colaboración con el Centro de Regulación Genómica, han descubierto que el gen RING1B es crítico para el desarrollo del sarcoma de Ewing, un tipo de cáncer poco frecuente que se presenta en los huesos y tejidos blandos. Esta nueva vulnerabilidad epigenética en las células cancerosas abre la puerta al desarrollo de estrategias terapéuticas.
El sarcoma de Ewing es causado por una translocación cromosómica, donde el gen EWSR1 en el cromosoma 22 se fusiona con el gen FLI1 en el cromosoma 11. La proteína de fusión resultante, llamada EWSR1-FLI1, es el principal impulsor de la tumorigénesis gracias a la maquinaria de activación transcripcional de EWSR1 y el dominio de unión al ADN de FLI1.
La proteína EWSR1-FLI1 está dirigida a las diferentes partes del genoma por RING1B, permitiendo que dicha proteína secuestre el programa transcripcional de las células, lo que las convierte en células cancerosas
Un nuevo estudio publicado en Science Advances describe cómo la proteína de fusión oncogénica EWSR1-FLI1 está dirigida a las diferentes partes del genoma por RING1B, permitiendo que dicha proteína secuestre el programa transcripcional de las células, lo que las convierte en células cancerosas.
Los científicos encontraron que RING1B y EWSR1-FLI1 se localizan en las mismas regiones del genoma, donde RING1B es responsable del reclutamiento de EWSR1-FLI1. Así, EWSR1-FLI1 no puede activar sus genes diana y transformar una célula sana a una cancerosa sin RING1B. Los expertos mostraron que los tumores crecían peor cuando se reducía la expresión de RING1B.
“Nuestros hallazgos ofrecen información sorprendente sobre la maquinaria del sarcoma de Ewing, acercándonos a descubrir por fin la célula de origen de este tipo de cáncer raro”, explica Luciano Di Croce, profesor de Investigación ICREA del CRG y uno de los autores del estudio. “Todo lo que tenemos que hacer es buscar niveles altos de RING1B”.
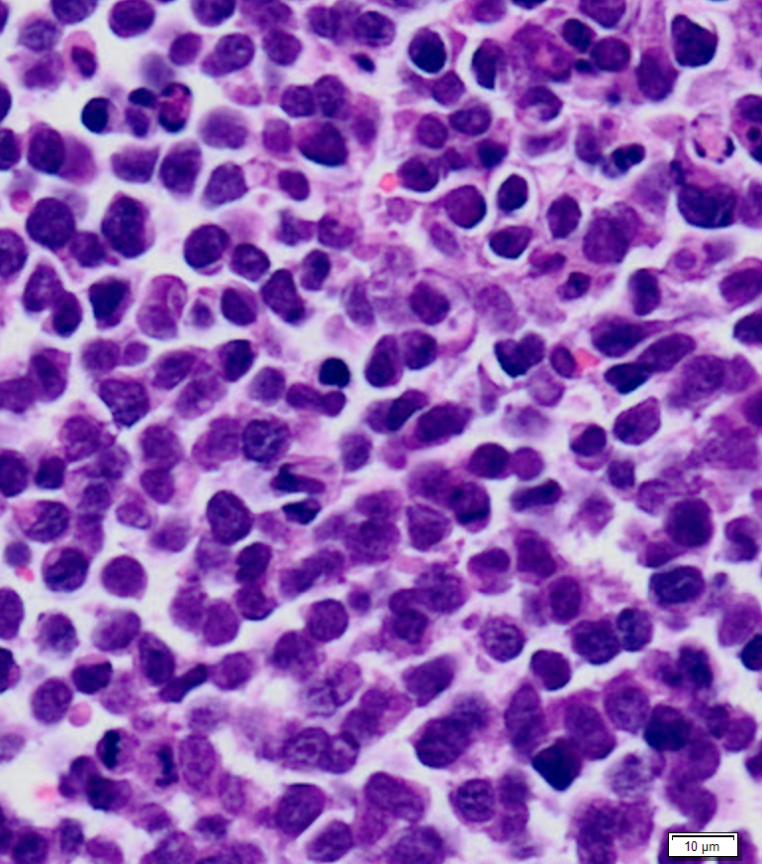
Tumores de xenoinjertos a partir de líneas celulares de sarcoma de Ewing; en lila la tinción standard con hematoxilin/eosin. / CRG
Una diana terapéutica desafiante
Previamente ya se habían propuesto inhibidores epigenéticos para tratar el sarcoma de Ewing y otros tipos de cánceres pediátricos como el neuroblastoma, el rabdomiosarcoma o el sarcoma sinovial. Futuras investigaciones pueden explorar la inhibición farmacológica de RING1B como terapia clínica para su tratamiento.
“EWSR1-FLI1 sigue siendo una diana terapéutica desafiante, por lo que comprender sus dependencias puede ofrecer estrategias alternativas para desconectar su programa transcripcional aberrante”, afirma Sara Sánchez-Molina, primera autora del estudio e investigadora postdoctoral en el Institut de Recerca Sant Joan de Déu.
La nueva vulnerabilidad epigenética encontrada en las células cancerosas abre la puerta al desarrollo de estrategias terapéuticas
“Los tumores de Ewing son ejemplos paradigmáticos de cánceres del desarrollo, donde el primer golpe (genético o epigenético) ocurre durante la gestación y, en la mayoría, se desarrolla postnatalmente durante etapas específicas de crecimiento como la pubertad”, apunta Jaume Mora, director científico del Centro Oncológico Pediátrico Barcelona - Institut de Recerca Sant Joan de Déu, y director del estudio.
“El estudio apoya el modelo por el cual las células madre embrionarias caracterizadas por altos niveles de RING1B son capaces de mantener el programa transcripcional aberrante causado por la proteína de fusión oncogénica. El sarcoma de Ewing se desarrollará si el individuo nace con células precursoras portadoras de la oncoproteína de fusión”, concluye Mora.
FUENTE
********************************************************
Este es el mecanismo molecular por el que un virus puede causar diabetes
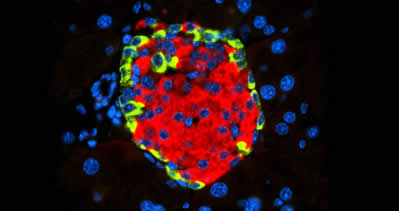
Islotes de Langerhans con insulina secretada por las células beta (en rojo) y glucagón secretado por las células alfa (en verde). / CNIO
La infección por algunos enterovirus –género de virus que comúnmente causan enfermedades de diversa gravedad– podría activar la aparición de diabetes, a pesar de que su efecto directo in vivo y su mecanismo de acción molecular son desconocidos.
Ahora, un equipo del Grupo de Factores de Crecimiento, Nutrientes y Cáncer, que lidera Nabil Djouder en el Centro Nacional de Investigaciones Oncológicas (CNIO), demuestra por primera vez cómo el enterovirus coxsackievirus tipo B4 (CVB4) podría inducir diabetes. El hallazgo, publicado en Cell Reports Medicine, constituiría un paso fundamental para abrir la vía a la búsqueda de nuevas estrategias terapéuticas.
Los autores apuntan, además, que el descubrimiento podría ser de relevancia para afrontar la pandemia de covid-19, ya que la información clínica indica una posible relación entre infección por SARS-CoV-2 y diabetes. “Dado que el receptor de este virus está expresado en el páncreas endocrino, podría operar y causar diabetes de una forma similar al CVB4, independientemente de la reacción inmunitaria”, sugieren.
Coxsackievirus B pertenece a la familia de los enterovirus; se sospechaba que podían causar diabetes en humanos, pero se desconocían los mecanismos moleculares de este efecto
Fallo en la producción de insulina
Coxsackievirus B pertenece a la familia de los enterovirus, que también incluye el polivirus y el echovirus, y puede causar desde enfermedades leves similares a la gripe hasta otras de mayor gravedad, como miocarditis, pericarditis, meningitis o pancreatitis. Se sospechaba que estos virus pueden causar diabetes en humanos, pero se desconocían los mecanismos moleculares de este efecto.
Con el objetivo de encontrar y describir estos sistemas, los científicos del CNIO trabajaron con modelos animales injertados con células pancreáticas humanas infectadas por CVB4, así como con células productoras de insulina tanto humanas como de ratón, también infectadas por este virus.
Así, observaron que la infección por CVB4 causa la desregulación de URI, una proteína que regula el funcionamiento de numerosas actividades celulares. “En este caso, dicha desregulación desencadena una cascada de eventos moleculares que llevan a la modificación del genoma mediante hipermetilación y silenciamiento de Pdx1”, explica Djouder.
Pdx1, un gen crítico
“Este es un gen crítico para la identidad y la función de las células beta presentes en el páncreas endocrino, en los llamados islotes de Langerhans, responsables de la producción y secreción de la insulina, la hormona que reduce los niveles de glucosa en sangre”, añade el experto. “El silenciamiento de PDX1 origina la pérdida de identidad y función de las células beta, que pasan a asemejarse a las células alfa, que están a cargo del aumento de los niveles de glucosa en sangre, lo que lleva a hiperglicemia y diabetes independientemente de la respuesta inmunitaria”.
Los investigadores comprobaron sus hallazgos mediante varios modelos de ratón modificados genéticamente y estudios genómicos, mostrando que la pérdida de URI en el páncreas de ratón altera la identidad y función de las células beta y causa diabetes. Además, observaron que ratones diabéticos que sobreexpresan URI en estas células son más tolerantes a la glucosa.
Finalmente, también observaron en páncreas procedentes de pacientes diabéticos que la expresión de URI, PDX1 y las partículas virales están correlacionadas en las células beta, indicando una relación causal entre la infección por enterovirus y la diabetes en humanos.
Aplicaciones en coronavirus
Los resultados podrían ayudar a avanzar los conocimientos sobre los efectos patológicos del virus causante de la actual pandemia: “A semejanza de nuestras investigaciones sobre los enterovirus, algunas observaciones clínicas recientes han asociado SARS-CoV-2 a la aparición de diabetes en pacientes infectados”, indica Djouder.
Los resultados podrían ayudar a avanzar los conocimientos sobre los efectos patológicos del virus causante de la actual pandemia
“Dado que el receptor de SARS-CoV-2 está presente en las células beta, sería interesante estudiar si este virus también altera la función de URI y silencia la expresión de PDX1 para afectar a la función de las células beta, promoviendo la diabetes”.
Los investigadores también sugieren que una posible estrategia preventiva y terapéutica podría ser utilizar, en combinación con terapias antivirales, inhibidores de la metiltransferasa de ADN, proteína responsable de la hipermetilación del genoma y el silenciamiento de Pdx1.
Es más, el equipo ha demostrado que esta clase de inhibidores restaura la expresión de PDX1 y la tolerancia a la glucosa en ratones diabéticos. Algunos de estos inhibidores ya han sido licenciados para su uso clínico en tratamientos oncológicos, lo que podría acelerar su aplicación en estos casos.
FUENTE

|


